Cu excepția traumatismelor, toate bolile sau afecțiunile medicale au o componentă genetică.
Înțelegerea modului în care variațiile din ADN-ul unui individ pot influența boala și sănătatea este punctul central al geneticii medicale.
În timp ce genetica este studiul genelor și al efectelor acestora, genetica medicală reprezintă orice aplicare a principiilor genetice la practica medicală.
Aceasta include studii privind moștenirea, cartografierea genelor bolilor, diagnosticul și tratamentul bolilor.
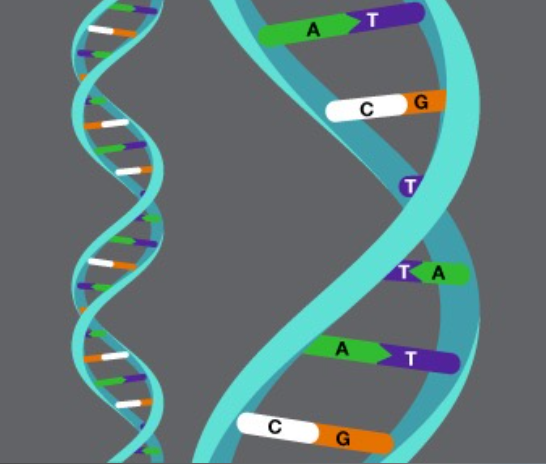
Genomul nostru este manualul de operare care conține toate instrucțiunile care ne-au ajutat să ne dezvoltăm de la o singură celulă la persoana de astăzi. Ne ghidează creșterea, ne ajută organele să își facă treaba și se repară singur atunci când este deteriorat. Și este unic. Cu cât știm mai multe despre genomul nostru și despre modul în care funcționează, cu atât ne vom înțelege mai bine propria sănătate și vom lua decizii în cunoștință de cauză în materie de sănătate.
Progresele în cunoașterea geneticii medicale au dus și vor continua să ducă la:
- modalități inovatoare de diagnosticare a bolilor;
- depistarea mai timpurie, prin identificarea predispoziției genetice la o anumită boală;
- noi abordări în materie de tratamente;
- dezvoltarea de medicamente care vizează o mutație genetică sau efectele acesteia (ramura numită farmacogenomică).
Genetica își are rădăcinile în secolul al 19-lea, când, în 1865, Gregor Mendel, călugăr și apoi stareț într-o mănăstire augustiniană, a descoperit legile eredității la mazărea de grădină, o realizare care a fost trecută cu vederea până când „mendelismul” a fost redescoperit în 1900.
Înainte de Mendel, însă, a existat lucrarea lui Joseph Adams (1756-1818), care, nu numai că a făcut distincția între tulburările congenitale ereditare și „dispoziții” (în cazul în care tulburarea se dezvoltă treptat de-a lungul vieții), dar a clasificat și „predispozițiile”, în cazul în care este nevoie de un factor extern (epigenetic) pentru ca tulburarea să devină evidentă la un individ.
Walther Flemming a vizualizat pentru prima dată cromozomii umani în celulele tumorale în 1882, iar Waldeyer a introdus termenul „cromozom” în 1888. În cursul anilor 1880, Roux, deVries și Weismann au dezvoltat teoria conform căreia cromozomii sunt purtătorii determinanților eredității și dezvoltării, iar în 1903, Walter Sutton și Theodor Boveri au propus teoria cromozomială a mendelismului.
În următoarea jumătate de secol, genetica s-a dezvoltat ca știință fundamentală, cu accent pe Drosophila, șoareci și porumb ca sisteme experimentale; majoritatea studiilor umane s-au bazat pe biostatistică și pe analize matematice bazate pe populație.
În această epocă, conceptul de „eugenie” a evoluat, rezultând într-o încercare a societății de a îmbunătăți fondul genetic și de a preveni diseminarea de gene “rele” în generațiile viitoare. Acest lucru a dus și la o varietate de practici eugenice profund condamnabile, prin care indivizilor cu deficiențe mintale, precum și celor cu malformații fizice li s-a interzis reproducerea, cu programe de sterilizare forțată, practici eugenice care au culminat in timpul regimului nazist din Germania.
O abordare științifică completă a geneticii umane a apărut în 1948, odată cu înființarea Societății Americane de Genetică Umană (ASHG). Puțini medici erau implicați în genetica umană la acea vreme, majoritatea fiind doctoranzi cu experiență în genetica formală (genetica populației sau statistică), a Drosophilei sau a șoarecilor. Unul dintre primii medici care a devenit genetician uman a fost James Neel, ale cărui studii au cuprins subiecte variind de la hemoglobinopatii la tulburările complexe, cum ar fi diabetul și genetica matematică la diverse populații. Neel era medic internist, la fel ca majoritatea celorlalte figuri medicale majore din domeniul geneticii din anii 1950. Cu toate acestea, odată cu evoluțiile explozive în genetica bolilor copilăriei din anii 1960 și 1970, mulți pediatri au căutat să se formeze în domeniul geneticii, iar programele de formare în genetica medicală au înflorit în departamentele de pediatrie, mai ales în Statele Unite ale Americii.
Chiar înainte de utilizarea tehnicilor moderne de laborator, departamentele de pediatrie au fost în avangarda descrierii clinice a tulburărilor genetice simple, a sindroamelor și a malformațiilor majore. F. Clarke Fraser a fost primul care a evidențiat „eterogenitatea genetică” în 1956, când a demonstrat că două cazuri similare din punct de vedere clinic pot fi diferite din punct de vedere genetic. Descrierea sindroamelor genetice și, ulterior, a eterogenității genetice a fost condusă de o serie de pediatri și alți profesioniști care lucrau în departamentele de pediatrie.
Una dintre cele mai influente persoane care a definit mecanismul defectelor congenitale a fost David W. Smith, pediatru și genetician clinic. Smith a inventat termenul „dismorfologie” pentru studiul sindroamelor de malformații structurale genetice și dobândite, cu luarea în considerare a cauzei și patogenezei acestora. El a dezvoltat conceptele de malformații congenitale cauzate de anomalii în formare, formare normală urmată de întreruperi cauzate de forțe externe sau deformări reversibile cauzate de presiuni externe.
Studiul malformațiilor structurale la om a fost precedat de descrieri similare la șoarece, de către persoane precum Joseph Warkany din Cincinnati, Ohio, SUA. Studiile sale au dus la definirea defectelor structurale, atât cele genetice, cât și a celor induse de mediu (epigenetice).
Dezvoltarea geneticii medicale ca specialitate și creșterea extraordinară a acesteia în departamentele de pediatrie a fost stimulată de progrese tehnologice majore, cum ar fi capacitatea de a vizualiza cromozomii umani, dezvoltarea metodelor de studiere a variațiilor biochimice din sânge și urină, cultura celulară, hibridizarea celulelor somatice și tehnologia moleculară, toate acestea permițând diagnosticarea, tratamentul și prevenirea tulburărilor genetice la copii. În plus, începutul citogeneticii umane moderne a fost posibil în special datorită tehnicilor de dezvoltare a culturii de țesuturi.
În afară de descoperirea, în 1956, a numărului corect de cromozomi umani, majoritatea descrierilor anomaliilor cromozomiale au provenit de la departamentele de pediatrie în studiul copiilor anormali. Prima dintre acestea a fost descoperirea de către Lejeune a unui cromozom 21 suplimentar în sindromul Down în 1959.
În 1969 și 1971, metodele de analiză a benzilor cromozomiale au dus la descrieri mult mai precise ale anomaliilor cromozomiale, în special cele care implică modificări structurale.
În scurt timp s-a constatat că practic toate celulele maligne purtau diverse anomalii cromozomiale, o constatare prezisă în 1914 de Boveri. Primul dintre acestea a fost cromozomul Philadelphia, depistat de Nowell și Hungerford pentru leucemia mielogenă cronică. Janet Rowley a descoperit ulterior că aceasta se datorează unei translocații între brațele lungi ale cromozomilor 9 și 22, ceea ce a dus la activarea necontrolată a unei gene parțial responsabile de diviziunea celulară, conducând astfel la creșterea necontrolată a celulelor mieloide.
În ultimii câțiva ani, noile tehnologii au dus la un proces de diagnosticare și mai rafinat al dezechilibrelor cromozomiale. Acestea au inclus utilizarea sondelor fluorescente (hibridizare in situ cu fluorescență) în scopul identificării exacte a cromozomilor și a părților acestora, precum și cartografierea genelor în locuri specifice de pe cromozomi. În plus, au fost dezvoltate tehnici de identificare multicoloră a cromozomilor, astfel încât un singur studiu fluorescent poate identifica mai multe anomalii, inclusiv cele care implică translocații, într-o singură celulă, deosebit de importante în cazul anomaliilor cromozomiale complexe din celulele maligne. Recent, s-a obținut o precizie și mai mare prin hibridizarea ADN-ului sau ARN-ului pe microplăci, ceea ce a dus la descoperirea supraexprimării și subexprimării unor gene specifice în celulele maligne.
Multe dintre descoperirile privind elementele fundamentale ale imunogeneticii umane, cum ar fi structura și variația moleculelor de imunoglobulină și diferitele subtipuri de celule T și B, au derivat din descrierea și studiul numeroaselor boli imunodeficitare moștenite din copilărie.
În prezent, un efort major este dedicat studiului componentei genetice a alergiilor, inclusiv a alergiilor alimentare, a astmului și a altor probleme comune la copii, toate acestea părând să fie din ce în ce mai frecvente. În mod similar, există un început de înțelegere a componentei genetice a bolilor autoimune, care, de asemenea, par să fie în creștere.
În această jumătate de secol de la 1953, când Watson și Crick au publicat lucrarea lor de referință privind structura ADN-ului, am asistat la evoluția rapidă a geneticii moleculare, care a culminat în 2003 cu secvențierea totală a genomului uman. Principalele repere de-a lungul procesului de secvențiere a genomului au fost descrierea codului genetic în 1966 de către Nirenberg, descoperirea enzimelor de restricție și utilizarea acestora în cartografierea ADN-ului în 1970, prima clonare a genelor umane în 1977, descrierea polimorfismelor de lungime a fragmentului de restricție și utilizarea acestora în cartografierea genelor în 1980 și inventarea PCR (reacție în lanț a polimerazei – Polymerase Chain Reaction) de către Mullis în 1985.
Genomul unui organism este stocat în moleculele de ADN, dar analiza acestei informații genetice necesită o cantitate destul de mare de ADN. În 1985, Kary Mullis a inventat procesul PCR, prin care o cantitate mică de ADN poate fi copiată în cantități mari într-o perioadă scurtă de timp. Prin aplicarea căldurii, cele două șiruri ale moleculei de ADN sunt separate, iar blocurile de ADN care au fost adăugate sunt lipite de fiecare șir. Cu ajutorul enzimei ADN-polimeraza, se formează noi lanțuri de ADN, iar procesul poate fi apoi repetat. PCR a avut o importanță majoră atât în cercetarea medicală (printre cele mai recente aplicații medicale se numără teste PCR de depistare a infectării cu SARS-COV2), cât și în știința criminalistică.
În ultimii 25 de ani, au fost identificate și clonate numeroase gene responsabile de boli genetice cu debut în copilărie, cu exemple timpurii precum distrofia musculară Duchenne, boala granulomatoasă cronică și fibroza chistică. Descoperirea genelor responsabile de mii de boli a revoluționat întreaga medicină și a dus la identificarea defectelor etiologice ale acestora, permițând noi perspective în ceea ce privește metodele de diagnosticare, prevenire și tratament al bolilor. De asemenea, a avut un impact major asupra înțelegerii cancerului, fiind descrise numeroase oncogene umane, cum ar fi genele responsabile de retinoblastom, neurofibromatoză.
Descoperirile și tehnicile citogenetice, biochimice și moleculare au condus la programe de diagnosticare și screening foarte eficiente pentru anomaliile cromozomiale, erorile înnăscute ale metabolismului și, în prezent, bolile structurale la copii. O metodă majoră de prevenire a bolilor genetice este diagnosticul prenatal, care este conceput pentru a detecta fetușii cu anomalii cromozomiale și genetice în cazul sarcinilor cu risc. Amniocenteza, prin care se obține o mostră de lichid amniotic, de obicei cu ghidare ecografică prin peretele abdominal, a fost prima metodă de diagnostic prenatal care a fost dezvoltată. Celulele derivate din acest lichid sunt apoi cultivate și supuse analizei cromozomiale și, atunci când este indicat, analizei biochimice sau moleculare.
Noi medicamente ce vor fi dezvoltate pe baza înțelegerii moleculare detaliate a bolilor frecvente, cum ar fi diabetul și hipertensiunea arterială, vor viza în mod logic moleculele. Ele vor putea fi adaptate la răspunsul probabil al pacientului. Mai mult, în timp, multe boli potențiale vor putea fi vindecate la nivel molecular înainte de a apărea. Este puțin probabil ca toate aceste schimbări să se producă rapid, dar accesul la secvențele genomului va modela din ce în ce mai mult practica medicinei în următoarele decenii.
Mirela Mustață, Redactor executiv E-asistent
Surse de documentare: