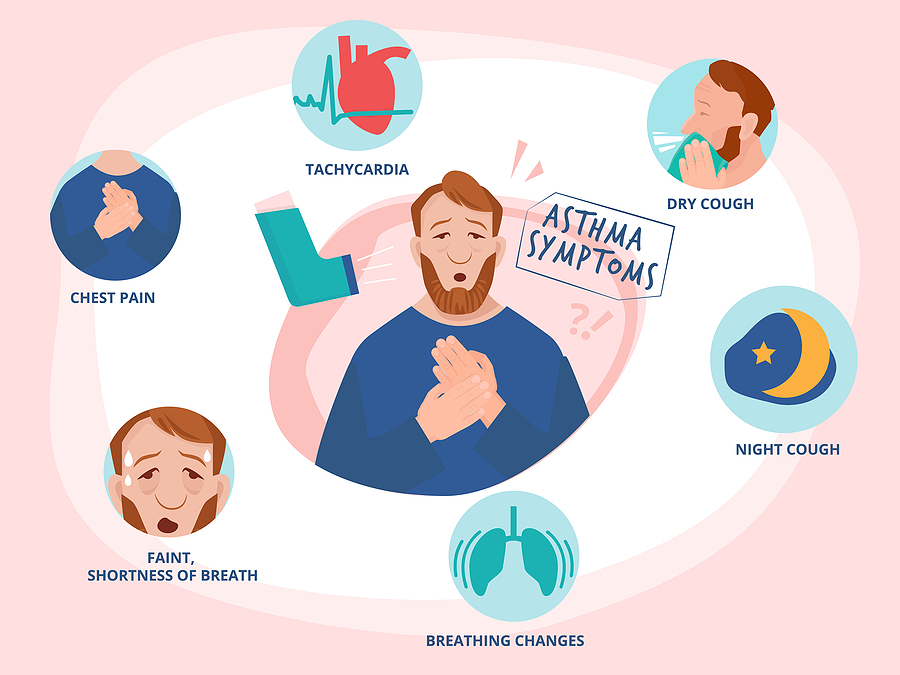
Statisticile arată că aproximativ 10% dintre persoane vor avea cel puțin un episod astmatic la un moment în viață, ceea ce face ca astmul să fie o boală relativ frecventă. Formele diferă semnificativ, de la cele ușoare până la cele grave, care provoacă dizabilitate sau chiar periculoase pentru viața pacientului.
Cuvântul „astm” provine din limba greacă și înseamnă „lipsă de aer”. Conceptul a fost rafinat în a doua parte a secolului al XIX-lea, odată cu publicarea unui tratat al lui Henry Hyde Salter intitulat „On Asthma and its Treatment„.
Salter a definit astmul ca fiind „dispnee paroxistică cu caracter specific, cu intervale de respirație sănătoasă între atacuri”, o descriere care surprinde conceptul său de boală în care căile respiratorii se îngustează din cauza contracției mușchilor netezi.
Cartea lui Salter conține ilustrații ale căilor respiratorii în astm și bronșită, precum și aspectul celular al sputei astmatice. De asemenea, Salter a descris cafeaua neagră ca tratament pentru spasmele astmatice, o băutură cu un conținut ridicat de teobromină, un derivat al teofilinei, și teofilina însăși.
Până la sfârșitul secolului al XIX-lea, medicii au adoptat punctul de vedere conform căruia astmul este o boală distinctă, cu un set specific de cauze, consecințe clinice și cerințe de tratament. Sir William Osler (unul dintre cei trei fondatori ai Școlii de Medicină John Hopkins din Baltimore, SUA) a descris astmul în prima sa ediție (1892) a manualului Principii și practici medicale în următorii termeni:
– spasm al mușchilor bronșici,
– umflare a mucoasei bronșice,
– o formă specială de inflamație a bronhiolelor mici,
– o afecțiune cu asemănări cu febra fânului,
– o afecțiune care debutează adesea în copilărie și durează uneori până la bătrânețe, cu o varietate bizară și extraordinară de circumstanțe care uneori induc un episod acut, precum atmosfera, fânul, praful, spaima sau emoția violentă.
Astmul a fost tratat în mare parte ca o boală a „bronhospasmului”, opinie întărită și de faptul că bronho-dilatatoarele cu teofilină, efedrină, adrenalină și, până în prima jumătate a secolului XX, izoprenalină ajutau la controlarea manifestărilor.
Cu toate acestea, însăși eficacitatea lor în inversarea bronhospasmului și siguranța lor inițială aparentă au dus la utilizarea lor fără restricții, fiind medicamente eliberate fără prescripție medicală.
Mulți specialiști consideră că dependența excesivă de bronhodilatatoare stă la baza epidemiei de decese cauzate de astm raportate în Australia, SUA și Regatul Unit, care a atins un vârf la mijlocul anilor 1960 (legat de izoprenalină) și un al doilea vârf în Noua Zeelandă la mijlocul anilor 1980 (legat de doze mari de fenoterol).
Aceste epidemii de decese cauzate de astm au scos în evidență deficiențele în tratamentul astmului și au evidențiat cât de puțin se înțelegeau cauzele pentru care căile respiratorii ale astmaticilor erau atât de predispuse la bronhospasm.
Deși se știa încă de la începutul anilor 1920 că decesul prin astm era asociat cu o inflamație extinsă și cu modificări structurale ale căilor respiratorii, nu se știa motivul pentru care se producea acest lucru și ce legătură avea cu bronhospasmul episodic.
În anii 1970-1980, s-a înțeles mai bine mecanismul prin care expunerea la alergeni ducea la o reactivitate sporită a căilor respiratorii în cazul astmaticilor.
Paradigma alergică a astmului a explicat, de asemenea, de ce agentul de stabilizare a mastocitelor, cromoglicatul de sodiu, a atenuat atât răspunsul bronhoconstrictor timpuriu, cât și cel tardiv indus de alergen.
Studiile clinice din anii 1970 au stabilit, de asemenea, că corticosteroizii inhalatori, în special dipropionatul de beclometazonă – BDP, sunt medicamente de control foarte eficiente pentru astm, când sunt administrate zilnic.
Descoperirea faptului că BDP reduce inflamația eozinofilă a căilor respiratorii, a mastocitelor și a celulelor mononucleare și abrogă reacția astmatică târzie la provocarea cu alergeni a reprezentat un important pas înainte.
O altă descoperire importantă a venit odată cu identificarea unui subset special de celule T capabile să secrete citokine care interacționează selectiv cu mastocitele, bazofilele și eozinofilele. Aceste celule T de tip Th2 au fost responsabile de recrutarea, pregătirea și supraviețuirea celulelor primare care produc cascada alergică.
La persoanele susceptibile genetic (atopice), alergenii predominanți în mediul interior și exterior au fost detectați și ulterior modificați de un al treilea set de celule, populația prezentatoare de antigen, în special celulele dendritice (DC) care s-au acumulat la suprafețele epiteliale, cum ar fi căile respiratorii.
Ultimul deceniu a fost martorul unei creșteri semnificative a cunoștințelor despre modul în care DC recunosc alergenii și comunică semnalul de sensibilizare specific celulelor T naive, implicând prezentarea peptidelor alergenice restricționate de clasa II MHC la receptorul celulelor T (CD3) și implicarea moleculelor co-stimulatoare.
Astfel, o combinație de susceptibilitate genetică și expunere la alergeni este crucială pentru inițierea și apoi perpetuarea cascadei alergice prin intermediul comunicării DC-celule T. Din cauza fondului genetic și a expunerii la mediul înconjurător, este probabil ca astmul asociat cu alergenii să varieze foarte mult.
Astfel, expunerea la alergeni în contexte specifice a deschis un nou capitol de înțelegere a fiziopatologiei astmului. În acest context, au apărut testele clinice cu omalizumab, care au dovedit inhibarea aproape totală a răspunsurilor astmatice timpurii și tardive la alergenul inhalat.
Studiile privind biopsia căilor respiratorii, sângele și sputa au evidențiat, de asemenea, activitățile antiinflamatorii ale omalizumabului. Cu toate acestea, doar o treime până la jumătate dintre pacienții cu astm alergic sever au părut să răspundă la omalizumab, ceea ce a condus la recomandarea ca răspunsul la tratament la 16 săptămâni să fie evaluat cu ajutorul unor criterii de evaluare multiple.
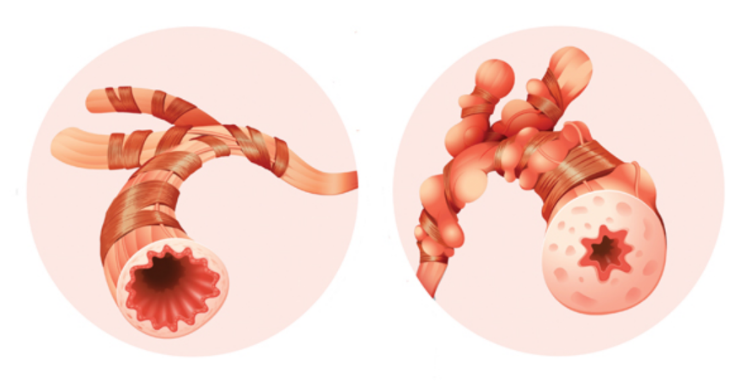
În plus față de inflamația căilor respiratorii, există modificări structurale extinse care apar în căile respiratorii astmatice și care sunt deosebit de importante pe măsură ce boala capătă un fenotip mai sever și mai cronic. Acestea includ metaplazia mucoasă epitelială sau o creștere a mușchiului neted propriu-zis și proliferarea micro-vaselor și a nervilor. Aceste modificări sunt denumite remodelare. Grosimea crescută a laminei reticulare sub-epiteliale este specifică astmului și, de asemenea, se accentuează odată cu severitatea bolii, dar nu și cu durata acesteia.
În plus față de alterarea funcției de barieră fizică, epiteliul căilor respiratorii poate fi, de asemenea, deficitar din punct de vedere funcțional în cazul astmaticilor. Un exemplu în acest sens este capacitatea redusă a epiteliului căilor respiratorii de a se proteja împotriva leziunilor provocate de oxidanți, precum fumul de tutun sau poluanții atmosferici externi – ozon, oxizi de azot și particule, despre care se știe că determină deteriorarea controlului astmului.
Un alt exemplu este ușurința cu care virusuri respiratorii comune și de obicei inofensive (de exemplu, cele care provoacă răceli obișnuite) pot provoca o deteriorare gravă a controlului astmului (exacerbări), ceea ce duce la necesitatea de a intensifica tratamentul, de a solicita ajutor medical sau de a urma o internare în spital.
Studiile de monitorizare a astmului efectuate în emisfera nordică relevă o natură ciclică a exacerbărilor, atât în comunitate, cât și în cazul internărilor în spital. Un vârf important în septembrie-iarnă este urmat de vârfuri mai mici primăvara și vara. Primul este determinat de o infecție virală care implică o mare varietate de virusuri, dar este dominat de subclasele de rinovirus, în timp ce ultimele vârfuri mai mici se referă la mai multe vârfuri de expunere la polen, de exemplu. În climatele mai tropicale, sezonalitatea exacerbărilor de astm nu mai este evidentă, ceea ce sugerează că condițiile climatice sunt importante pentru crearea acestei periodicități.
Descoperirea faptului că atât funcția de barieră a epiteliului, cât și imunitatea înnăscută sunt anormale în cazul astmului întărește opinia conform căreia epiteliul căilor respiratorii joacă un rol foarte important în astm.
O evoluție recentă importantă este descoperirea că infecția cu rinovirus în primii 2 ani de viață este un factor de risc mult mai puternic decât expunerea la alergeni la această vârstă.
Într-adevăr, în prezent, este din ce în ce mai probabil ca funcțiile epiteliale deficitare să predispună copilul cu risc genetic la dezvoltarea astmului.
Mirela Mustață, Redactor executiv E-asistent
Adaptare și traducere după: